Реакція Жуліа
| Реакція Жуліа | |
| Названо на честь | Marc Juliad |
|---|---|
| | |
Реа́кція олефінува́ння Жуліа́ (реакція Жуліа-Ліжо) — це реакція отримання алкенів, в результаті взаємодії фенілсульфону 1 з альдегідами (або кетонами) з наступним відновним елімінуванням з допомогою амальгами натрію або SmI2[1]. Реакція названа в честь французького хіміка Марка Жуліа (фр. Marc Julia), який відкрив її в 1973 році.
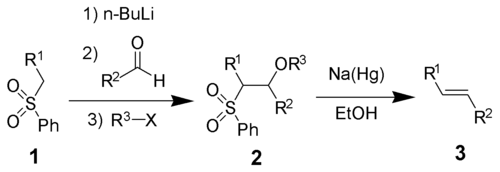
Всі чотири етапи реакції можуть бути проведені в одній посудині, а використання R3X не є обов'язковим. Однак очищення сульфонового проміжного продукту 2 дозволяє підвищити вихід реакції і чистоту продукту. Найчастіше R3 — це ацетильний або бензоїльний замісник, а для отримання 2 як R3X використовують ангідрид оцтової кислоти або бензоїлхлорид.
У результаті реакції утворюються переважно транс-алкени.
Реакція проходить через такі основні стадії: 1) приєднання α-метилфенілсульфонату до альдегіду або кетону; 2) ацилювання отриманого β-алкоксисульфонату; та 3) відновного відщеплення β-ацилоксисульфонату (з допомогою амальгами натрію або SmJ2) для отримання бажаного продукту.
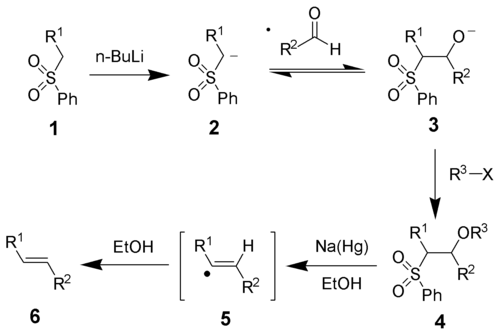
Перші стадії є прямими. Фенілсульфоновий аніон 2 реагує з альдегідом, в результаті чого утворюється алкоксид 3, який у свою чергу функціоналізують з допомогою R3-X з утворенням стабільного інтермедіату 4. Точний механізм класичної реакції Жуліа не відомий, але з допомогою маркування Дейтерієм було показано, що реакція проходить через стадію утворення вінільних або вторинних алкільних радикалів 5[2]. Обидва інтермедіати з різною стереохімією здатні еквілібрувати до більш стабільних ізомерів перед утворенням продукту. Бажаний продукт 6 утворюється в результаті протонування вінільних радикалів. Стереохімія алкену 6 залежить від стереохімії сульфонового інтермедіату 4. Вважається, що радикальні інтермедіати 5 з різною стереохімією здатні еквілібрувати, в результаті чого утворюються термодинамічно більш стабільні транс-олефіни[3].
У результаті класичної реакції Жуліа утворюються переважно транс-(або (Е)-)алкени з високим стереоселективним виходом. (Е)-селективність можа підвищити, якщо використовувати такі вихідні сполуки, щоб ланцюги біля новоутвореного подвійного зв'язку були якомога більш розгалуженими. Відносна стереохімія інтермедіату β-ацилоксисульфонату не впливає на геометрію отриманого алкену.
Оскільки весь синтез досить важко провести в лабораторії, Марк Жуліа зі співробітниками розробив метод синтезу «в одній посудині», де гетероарилсульфонати додаються до карбонільних сполук замість традиційних фенілсульфонатів[4]. (Хоча очищення сульфонового інтермедіату в середині синтезу дає змогу отримати кращий вихід та чистіший продукт.)
Заміщення фенілсульфонів на гетероарилсульфони значно змінює шлях проходження реакції[5]. Показовим прикладом є бензотіазолсульфон[6]. Реакція бензотіазолсульфону 1 з Літій диізопропіламідом дає метилбензотіазоліл сульфон, який швидко реагує з альдегідами (або кетонами) з утворенням алкоксидного інтермедіату 2. На відміну від фенілсульфонів, такі алкоксидний інтермедіат 2 є нестабільним та піддається перегрупуванню Смайлза з утворенням сульфінатної солі 4[7]. Остання одразу ж розкладається на діоксид Сульфуру та бензотіазолон Літію 5 даючи бажаний алкен 6.

Оскільки реакція Жуліа з використанням бензотіазолу не має стадії з утворенням різноважних інтермедіатів, стереохімічних вихід залежить від стереохімії початкого карбонільного приєднання. Тому продуктом реакції завжди є суміш стереоізомерних алкенів.
Після аналізу кількох гетероароматичних активаторів, стало зрозуміло, що не всі гетероарилсульфонати однаково впливають на вихід продукту та стереосективність[5]. Бензотіазол-2-іл сульфони реагують з α,β-ненасиченими або ароматичними альдегідами з утворенням спряжених 1,2-дизаміщенів (Е)-алкенів. Кочинські (англ. Philip J. Kocieński) помітив, що 1-феніл-1Н-тетразол-5-їл сульфон дає неспряжені 1,2-дизаміщені алкени з високим (Е)-селективним виходом, якщо немає значного стеричного напруження в молекулі[8].
У реакції Жуліа — Кочинські алкілуючим агентом є тетразол[9]. Така реакція проходить за тим же механізмом, що й реакція з бензотіазолсульфоном. У іншому випадку[10], реакція з трет-бутилтетразоїлметилсульфоном може проходити в тетрагідрофурані з біс-(триметилсиліл)амідом при −70 °С або ж з карбонатом цезію при +70 °С.
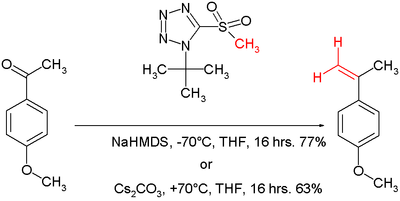
Високий (Е)-селективний вихід олефінування Жуліа-Кочинскі є наслідком кінетично контрольованого, незворотного діастереоселективного приєднання метальованого 1-феніл-1Н-тетразол-5-їл сульфону до неспряжених альдегідів з утворенням anti-β-алкоксисульфонів, які стереоспецифічно розкладаються до (Е)-алкенів. Для отримання 1,2-дизаміщених (Z)-алкенів рекомендують використовувати алільні або бензильні 1-t-бутил-1Н-тетразол-5-іл сульфони[11][12].
- ↑ Julia, M.; Paris, J.-M. Tetrahedron Lett. 1973, 14, 4833-4836. (Стаття)
- ↑ Keck, G. E., Savin, K. A., Weglarz, M. A. J. Org. Chem. 1995, 60, 3194. (Стаття)
- ↑ Wadsworth, D. H., Schupp, I. O. E., Sous, E. J., Ford, J. J. A. J. Org. Chem. 1965, 30, 680. (Стаття)
- ↑ Baudin, J. B., Hareau, G., Julia, S. A., Ruel, O. Tetrahedron Lett. 1991, 32, 1175. (Стаття)
- ↑ а б Blakemore, P. R. J. Chem. Soc., Perkin Trans. 1 2002, 2563. (Стаття)
- ↑ Baudin, J. B.; Hareau, G.; Julia, S. A.; Ruel, O. Tetrahedron Lett. 1991, 32, 1175. (Стаття)
- ↑ Truce, W. E.; Kreider, E. M.; Brand, W. W. Org. React. 1970, 18, 99. (Стаття)
- ↑ Blakemore, P. R., Cole, W. J., Kocienski, P. J., Morley, A. Synlett 1998, 26. (Стаття)
- ↑ Blakemore P. R., Cole W. J., Kocieński P. J., Morley A. Synlett 1998, 26. (Стаття)
- ↑ Aïssa Ch. J. Org. Chem. 2006, 71, 360. (Стаття)
- ↑ Satoh, T., Yamada, N., Asano, T. Tetrahedron Lett. 1998, 39, 6935. (Стаття)
- ↑ Horner, L., Hoffmann, H., Wippel, H. G. Chem. Ber. 1958, 91, 61. (Стаття)
- Clayden J., Greeves N., Warren S. Organic chemistry. — 2nd ed. — Oxford University Press, 2012. — P. 686—688. — ISBN 978-0-19-927029-3.
- Глосарій термінів з хімії / укладачі: Й. Опейда, О. Швайка ; Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Донецьк : Вебер, 2008. — 738 с. — ISBN 978-966-335-206-0.